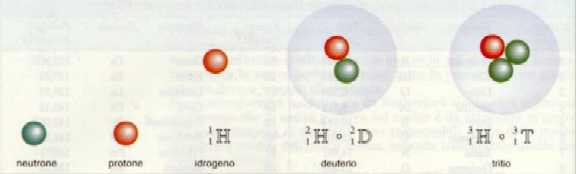
L'atomo, la più piccola frazione di un elemento in grado di conservarne le caratteristiche chimiche e fisiche, è una struttura complessa costituita da diversi tipi di particelle: protoni (associati ad una carica positiva), neutroni (elettricamente neutri) ed elettroni (associati ad una carica negativa).
Protoni e neutroni (a loro volta formati da particelle elementari dette Quark) sono riuniti nel nucleo, intorno al quale sono distribuiti gli elettroni. Il diverso numero di protoni nel nucleo caratterizza i differenti elementi (quelli finora noti sono 110 circa): tale numero è detto numero atomico Z; il numero di nucleoni (in pratica la somma del numero di protoni e neutroni) costituisce la massa dell'atomo, definita numero di massa, A .

L'unità di misura del peso atomico è l'unità di massa atomica o a. m. u. (atomic mass unity) ed è fissata in 1/12 della massa del carbonio C12. In Italia é anche conosciuta come UMA, dalla traduzione inglese di a. m. u.